- Toate
- Teste cultura generala
- Teste psihologice
- Teste matematica
- Teste romana
- Teste anatomia omului
- Teste de botanica
- Teste filme
- Teste din istorie
- Teste de geografie
- Teste din astronomie
- Teste de logica
- Teste de chimie
- Teste de zoologie
- Teste despre desene animate
- Teste muzica
- Teste vedete
- Teste compatibilitate
- Mini-teste
- Teste haioase
- Teste fete
- Teste baieti
- Teste iubire
- Teste din referate pentru scoala
Afla ca sa stii
Jurnalul lui Aurel
De ce parintii fac pe politistul bun si politistul rau? Ai vazut probabil in filme cu politisti ca o echipa este formata din unul bun si unul rau. Si daca recunosti tiparul, sigur ti-ai dat seama...
› citeste mai multStiri
Bancul zilei
Ioane, cumparatu-ti-ai masina?
- Cumparat, ma Gheo!
- Ce culoare?
- Pai ma Gheo, ai vazut ceriul la apusu' soarelui?
- Vazut-am!
- E, tot ase ii, numa' ca verde.
Cultura generala
Virusul NU poate fi vazut cu un microscop optic. Virusul poate fi vazut doar la un microscop electronic. Unele microscoape electronice ajung sa transmita o imagine marita de 2 milioane de ori. Ca o comparatie, bacteria este de cel putin o suta de ori mai mare ca un virus obisnuit.
› vrei mai multExtemporal la astronomie
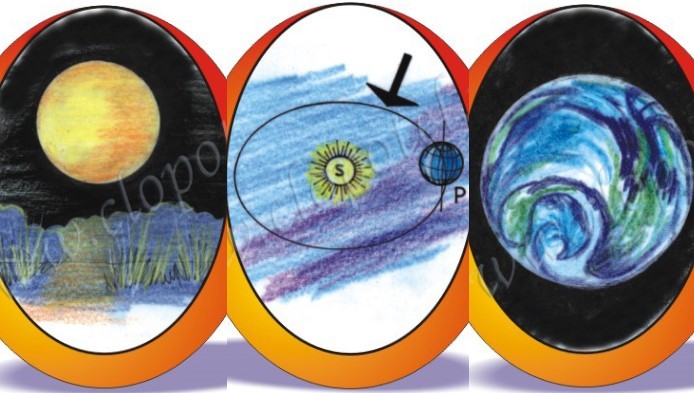
Testul pasionatului de astronomie

Shop Clopotel.ro
Test de cultura generala: Planete telurice sau gazoase?

Cand va veni sfarsitul lumii?